Metales pesados
Los metales pesados están principalmente presentes en::
- La cadena trófica (Zurera-Cosano et al., 1989; Ellen et al., 1990; Cambra et al., 1999; DEFRA, 1999; Islam et al., 2007; Zhang et al., 2016; Liang et al., 2019).
- Agua para consumo humano (revisado en Brown y Margolis, 2012; Sorlini et al., 2014; Annibaldi et al., 2018; Gallego Reyes et al., 2019).
- Cosméticos (revisado en Bocca et al., 2014; revisado en Borowska y Brzóska, 2015; Lim et al., 2018).
- Bombillas de bajo consumo (Jang et al., 2005; Johnson et al., 2008; Glenz et al., 2009; Nance et al., 2012; Salthammer et al., 2012; Sarigiannis et al., 2012; Shao et al., 2012; Lim et al., 2013).
- Empastes de amalgamas de mercurio (revisado en Homme et al., 2014; revisado en Kern et al., 2014).
La intoxicación por metales pesados induce entre otras, patologías neurológicas/psiquiátricas (revisado en Mason et al., 2013; revisado en Jackson, 2018) y cáncer (revisado en Naujokas et al., 2013; revisado en Genchi et al., 2020).
Las publicaciones científicas a partir del siglo XXI han comenzado a demostrar que algunos metales pesados también actúan como disruptores endocrinos afectando negativamente de forma adicional a nuestra salud (Iavicoli et al., 2009; revisado en Tan et al., 2009; revisado en Sun et al., 2016; revisado en Sabir et al., 2019; Vu et al., 2019).
-
Annibaldi A, Illuminati S, Truzzi C, Scarponi G. Heavy Metals in Spring and Bottled Drinking Waters of Sibylline Mountains National Park (Central Italy). J Food Prot. 2018 Feb;81(2):295-301. doi: 10.4315/0362-028X.JFP-17-310. Bocca B, Pino A, Alimonti A, Forte G. Toxic metals contained in cosmetics: a status report. Regul Toxicol Pharmacol. 2014 Apr;68(3):447-67. doi: 10.1016/j.yrtph.2014.02.003. Epub 2014 Feb 12.
-
Borowska S, Brzóska MM. Metals in cosmetics: implications for human health. J Appl Toxicol. 2015;35(6):551–572. doi:10.1002/jat.3129.
-
Brown MJ, Margolis S. Lead in drinking water and human blood lead levels in the United States. MMWR Suppl. 2012;61(4):1-9.
-
Cambra K, Martínez T, Urzelai A, Alonso E. Risk analysis of a farm area near a lead- and cadmium- contaminated industrial site. J. Soil Contam. 1999 8(5): 527-540. [doi:10.1080/10588339991339450].
-
Ellen G, Loon JW, Tolsma K. Heavy metals in vegetables grown in the Netherlands and in domestic and imported fruits. Z. Lebensm. Unters. Forsch. 1990 190(1): 34-39. [doi:10.1007/BF01188261].
-
Gallego Reyes SM, Martínez Beneyto Y, Serna-Muñoz C, Pérez-Silva A, Cury JA, Ortiz Ruiz AJ. Concentración de flúor y metales pesados en aguas embotelladas: medidas barrera frente a caries dental y fluorosis [Fluoride and heavy metals concentration in bottled waters: barrier measures against dental caries and fluorosis]. Rev Esp Salud Publica. 2019;93:e201912110. Published 2019 Dec 17.
-
Genchi G, Sinicropi MS, Lauria G, Carocci A, Catalano A. The Effects of Cadmium Toxicity. Int J Environ Res Public Health. 2020;17(11):3782. Published 2020 May 26. doi:10.3390/ijerph17113782.
-
Glenz TT, Brosseau LM, Hoffbeck RW. Preventing mercury vapor release from broken fluorescent lamps during shipping. J Air Waste Manag Assoc. 2009 Mar;59(3):266-72.
-
Homme KG, Kern JK, Haley BE, Geier DA, King PG, Sykes LK, Geier MR. New science challenges old notion that mercury dental amalgam is safe. Biometals. 2014 Feb;27(1):19-24. doi: 10.1007/s10534-013-9700-9. Epub 2014 Jan 14.
-
Iavicoli I, Fontana L, Bergamaschi A. The effects of metals as endocrine disruptors. J Toxicol Environ Health B Crit Rev. 2009;12(3):206‐223. doi:10.1080/10937400902902062.
-
Islam Eu, Yang XE, He ZL, Mahmood Q. Assessing potential dietary toxicity of heavy metals in selected vegetables and food crops. J Zhejiang Univ Sci B. 2007 Jan;8(1):1-13.
-
Jackson AC. Chronic Neurological Disease Due to Methylmercury Poisoning. Can J Neurol Sci. 2018;45(6):620‐623. doi:10.1017/cjn.2018.323.
-
Jang M, Hong SM, Park JK. Characterization and recovery of mercury from spent fluorescent lamps. Waste Manag. 2005;25(1):5-14.
-
Johnson NC, Manchester S, Sarin L, Gao Y, Kulaots I, Hurt RH. Mercury vapor release from broken compact fluorescent lamps and in situ capture by new nanomaterial sorbents. Environ Sci Technol. 2008 Aug 1;42(15):5772-8.
-
Kern JK, Geier DA, Bjørklund G, King PG, Homme KG, Haley BE, Sykes LK, Geier MR. Evidence supporting a link between dental amalgams and chronic illness, fatigue, depression, anxiety, and suicide. Neuro Endocrinol Lett. 2014;35(7):537-52.
-
Liang G, Gong W, Li B, Zuo J, Pan L, Liu X. Analysis of Heavy Metals in Foodstuffs and an Assessment of the Health Risks to the General Public via Consumption in Beijing, China. Int J Environ Res Public Health. 2019;16(6):909. Published 2019 Mar 13.
-
Lim DS, Roh TH, Kim MK, Kwon YC, Choi SM, Kwack SJ, Kim KB, Yoon S, Kim HS, Lee BM. Non-cancer, cancer, and dermal sensitization risk assessment of heavy metals in cosmetics. J Toxicol Environ Health A. 2018;81(11):432‐452. doi:10.1080/15287394.2018.1451191.
-
Lim SR, Kang D, Ogunseitan OA, Schoenung JM. Potential environmental impacts from the metals in incandescent, compact fluorescent lamp (CFL), and light-emitting diode (LED) bulbs. Environ Sci Technol. 2013 Jan 15;47(2):1040-7. doi: 10.1021/es302886m. Epub 2012 Dec 28.
-
Mason LH, Mathews MJ, Han DY. Neuropsychiatric symptom assessments in toxic exposure. Psychiatr Clin North Am. 2013 Jun;36(2):201-8. doi: 10.1016/j.psc.2013.02.001. Epub 2013 Apr 15.
-
Nance P, Patterson J, Willis A, Foronda N, Dourson M. Human health risks from mercury exposure from broken compact fluorescent lamps (CFLs). Regul Toxicol Pharmacol. 2012 Apr;62(3):542-52. doi: 10.1016/j.yrtph.2011.11.008. Epub 2011 Nov 28.
-
Naujokas M, Anderson B, Ahsan H, Aposhian HV, Graziano JH, Thompson C, Suk WA. The broad scope of health effects from chronic arsenic exposure: Update on a worldwide public health problem. Environ. Health Perspect. 2013;121:295–302. doi: 10.1289/ehp.1205875.
-
Sabir S, Akash MSH, Fiayyaz F, Saleem U, Mehmood MH, Rehman K. Role of cadmium and arsenic as endocrine disruptors in the metabolism of carbohydrates: Inserting the association into perspectives. Biomed Pharmacother. 2019 Jun;114:108802. doi: 10.1016/j.biopha.2019.108802. Epub 2019 Mar 25.
-
Salthammer T, Uhde E, Omelan A, Lüdecke A, Moriske HJ. Estimating human indoor exposure to elemental mercury from broken compact fluorescent lamps (CFLs). Indoor Air. 2012 Aug;22(4):289-98. doi: 10.1111/j.1600-0668.2011.00764.x. Epub 2012 Jan 17.
-
Sarigiannis DA, Karakitsios SP, Antonakopoulou MP, Gotti A. Exposure analysis of accidental release of mercury from compact fluorescent lamps (CFLs). Sci Total Environ. 2012 Oct 1;435-436:306-15. doi: 10.1016/j.scitotenv.2012.07.026. Epub 2012 Aug 2.
-
Shao DD, Wu SC, Liang P, Kang Y, Fu WJ, Zhao KL, Cao ZH, Wong MH. A human health risk assessment of mercury species in soil and food around compact fluorescent lamp factories in Zhejiang Province, PR China. J Hazard Mater. 2012 Jun 30;221-222:28-34. doi: 10.1016/j.jhazmat.2012.03.061. Epub 2012 Apr 1.
-
Sorlini S, Gialdini F, Collivignarelli C. Metal leaching in drinking water domestic distribution system: an Italian case study. Int J Environ Health Res. 2014;24(6):497-514. doi:10.1080/09603123.2013.865715.
-
Sun HJ, Xiang P, Luo J, Hong H, Lin H, Li HB, Ma LQ. Mechanisms of arsenic disruption on gonadal, adrenal and thyroid endocrine systems in humans: A review. Environ Int. 2016 Oct;95:61-8. doi: 10.1016/j.envint.2016.07.020. Epub 2016 Aug 6.
-
Tan SW, Meiller JC, Mahaffey KR. The endocrine effects of mercury in humans and wildlife. Crit Rev Toxicol. 2009;39(3):228-69. doi: 10.1080/10408440802233259.
-
Vu V, Navalkar N, Wei Y. Endocrine-disrupting metals in ambient air and female breast cancer incidence in US. Gynecol Endocrinol. 2019 Dec;35(12):1099-1102. doi: 10.1080/09513590.2019.1622089. Epub 2019 May 29.
-
Zhang Y, Lu X, Wang N, Xin M, Geng S, Jia J, Meng Q. Heavy metals in aquatic organisms of different trophic levels and their potential human health risk in Bohai Bay, China. Environ Sci Pollut Res Int. 2016;23(17):17801-17810. doi:10.1007/s11356-016-6948-y.
-
Zurera-Cosano G, Moreno-Rojas R, Salmeron-Egea J, Pozo Lora R. Heavy metal uptake from greenhouse border soils for edible vegetables. J. Sci. Food Agric. 1989 49(3):307-314. [doi:10.1002/jsfa.2740490307].
-
DEFRA (Department of Environment, Food and Rural Affairs). Total Diet Study—Aluminium, Arsenic, Cadmium, Chromium, Copper, Lead, Mercury, Nickel, Selenium, Tin and Zinc. The Stationery Office, London. 1999.
Empastes de amalgamas de mercurio
Los empastes de amalgamas de mercurio son un material utilizado por dentistas, que se aparecieron en el mundo occidental en la década de 1830, y que han sido objeto de numerosas controversias desde entonces debido a su alto contenido de mercurio elemental (Bjørklund, 1989; revisado en Kern et al., 2014).
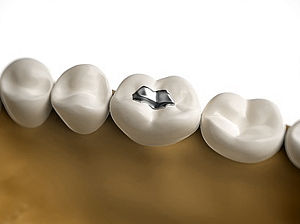
Actualmente, la amalgama dental es una mezcla en peso de aproximadamente el 50% de mercurio, entre el 22 y 32% de plata, el 14% de estaño y el 8% de cobre, así como otros metales, dependiendo del tipo de amalgama (Brune, 1986; Ferracane, 2001). Cada uno de estos constituyentes puede tener riesgos para la salud por su toxicidad pero la mayor preocupación reside en el mercurio por su alta volatilidad a temperatura corporal, que hace que se esté liberando este metal pesado de manera continua (revisado en Kern et al., 2014). Aunque el uso de empastes de amalgamas de mercurio puede estar en declive, debido a que algunos países los han prohibido y otros aconsejan no ponerlos ni a mujeres embarazadas ni a niños (revisado en Kern et al., 2014), todavía constituye el 45% de las restauraciones dentales en todo el mundo (Heintze y Rousson, 2012).
Exposición y absorción
Las vías de exposición a mercurio a través de las amalgamas son:
- El vapor que es absorbido por la cavidad oral e inhalado por los pulmones (ATSDR, 1999).
- Los productos de corrosión metálica y la erosión por la saliva que luego es ingerida (Brune y Evje 1985; Enestrom y Hultman 1995).
Los empastes de amalgamas de mercurio son la fuente predominante de exposición humana a mercurio elemental e inorgánico para la población general (Clarkson et al., 1988).
Además, las amalgamas de mercurio también afectan a la flora intestinal al incrementar tanto especies resistentes a este metal pesado como a antibióticos (revisado en Lorscheider et al. 1995a; Summers et al. 1993). Por otro lado, los empastes de amalgamas también pueden ser una fuente de mercurio orgánico generado por microorganismos del tracto gastrointestinal que lo generan a partir del mercurio inorgánico liberado por éstos (Gilmour et al., 2013).
Niveles de mercurio en sangre, orina y aire intraoral
Diferentes grupos de investigación han demostrado la correlación entre la extensión de los empastes de amalgamas de mercurio y los niveles de mercurio en sangre (Abraham et al., 1984), orina (Olstad et al., 1987; Dunn et al., 2008; Geiger et al., 2012; Woods et al., 2007) y aire intraoral (Vimy y Lorscheider, 1985).
Además de la extensión de los empastes, también se ha demostrado otros parámetros que se correlacionan con la presencia de mercurio en orina como la edad en la que se puso el empaste (Geier et al., 2012) y el tiempo transcurrido desde que se realizado el empaste (Woods et al., 2007).
Es importante destacar que, aunque los niveles de mercurio en orina o sangre parecen reflejar la exposición reciente a mercurio, esta relación puede no darse para algunas personas que pueden tener una predisposición a retener el mercurio (Mutter et al., 2007).
Además, ni la orina ni los niveles de sangre de mercurio reflejan la carga corporal o la toxicidad (Berlin et al., 2007). De hecho, algunas personas con una alta carga corporal de mercurio pueden mostrar niveles bajos en sangre, orina y cabello, aparentemente debido a que los procesos de desintoxicación bioquímica del mercurio estuvieran alterados, dando lugar a un aumento de la retención de este metal pesado (Mutter et al., 2007).
Presencia de mercurio en tejidos y órganos
El vapor de mercurio elemental de la amalgama dental es absorbido en la cavidad oral y los pulmones (Berlin et al., 2007). Tras la captación por la sangre y las células tisulares, los átomos de mercurio elemental se oxidan a mercurio divalente. Por otro lado, antes de que se lleve a cabo dicha oxidación, una porción de los átomos de mercurio elemental pueden cruzar la barrera hematoencefálica (y la placenta), donde se oxidan a la forma divalente y se acumulan a nivel tisular (Clarkson 1989).
Los órganos diana principales de la toxicidad de mercurio son el cerebro y los riñones, si bien también lo son la retina, la tiroides, el corazón, los pulmones y el hígado (revisado en Kern et al., 2014). Así lo confirman los datos obtenidos en diferentes artículos científicos:
- En modelos animales (ovejas y monos) tras la colocación de la amalgama (revisado en Lorscheider et al., 1995b).
- En estudios epidemiológicos (Bjørklund, 1991; Barregard et al., 2010; Geier et al., 2013).
- En autopsias humanas (Guzzi et al., 2006; Björkman et al., 2007).
Por lo que respecta a la exposición embrionaria a mercurio a través de los empastes de amalgamas de mercurio maternas también se han publicado varios artículos. Así, se ha observado una correlación significativamente dependiente de dosis entre el número (extensión/superficie) de empastes de amalgama materna y niveles de:
- Mercurio inorgánico y mercurio total en el cordón umbilical (Palkovicova et al., 2008; Vahter et al., 2000).
- Mercurio inorgánico en la placenta (Ask et al., 2002).
- Mercurio en líquido amniótico (Luglie et al., 2003).
- Mercurio en leche materna (Drasch et al., 1998; Oskarsson et al., 1996).
- Pelo de niños no autistas; no así en el pelo de los niños autistas, lo que ha planteado la posibilidad de que tengan alterado el proceso de excreción de mercurio (Holmes et al., 2003).
Estos datos epidemiológicos son similares a los que se han publicado en modelos animales (Takahashi et al., 2001, 2003).
Exposición a mercurio y enfermedades crónicas
Se sabe que los altos niveles de exposición a mercurio causan problemas sanitarios (ATSDR, 1999; revisado en Kern et al., 2014), pero los efectos de las exposiciones crónicas de bajo nivel no están tan claros. Sin embargo, la reciente identificación de varios genes que transmiten susceptibilidad a la toxicidad de mercurio, así como la identificación de sutiles pero importantes efectos adversos para la salud asociados con exposiciones crónicas a dosis bajas de mercurio, han elevado el nivel de preocupación (revisado en Kern et al., 2014).
Los estudios poblacionales sobre exposición a mercurio se enfrentan a varios problemas (revisado en Mutter et al., 2004; revisado en Kern et al., 2014):
- Los efectos para la salud de las exposiciones a mercurio son variados e inespecíficos pudiendo aparecer al cabo de muchos años.
- Muchos factores genéticos no identificados pueden afectar a los individuos, y sin embargo, ser enmascarados en estudios poblacionales.
- Además, la interpretación de las resultados puede ser difícil debido a las co-exposiciones con otros metales tóxicos, como arsénico y plomo, y/o moléculas orgánicas tóxicas como cloroformo y hidroquinona en el caso del personal de salud dental.
A pesar de estas limitaciones se han publicado artículos científicos que muestran cierta relación entre amalgamas de empastes de mercurio y algunas enfermedades crónicas mientras que no es así para otras patologías:
- Varias publicaciones han demostrado que la eliminación de los empastes de amalgamas de mercurio está asociada a la mejoría de los síntomas de pacientes con síndrome de fatiga crónica y fibromialgia (Stejskal et al., 1999; Yaqob et al., 2006; Stejskal et al., 2013).
- Los pacientes expuestos a empastes de amalgamas de mercurio tenían 1,583 veces más probabilidades de tener Parkinson posteriormente en comparación con los no expuestos después de ajustar por comorbilidades y puntuaciones del Charlson-Deyo Comorbidity Index (Hsu et al., 2016).
- En otro estudio no se mostró una relación entre el desarrollo de demencia y el volumen de los empastes de amalgamas de mercurio aunque entre las personas con demencia había casos en los que la progresión de la demencia se aceleraba cuando había gran volumen de empastes de amalgamas de mercurio (Mikhailichenko et al., 2019).
- Referente a esclerosis múltiple no se encontró relación entre empastes de amalgamas de mercurio y esta patología (Tseng et al., 2020a).
- No se encontró relación estadísticamente significativa entre empastes de amalgamas de mercurio y temblor esencial (Tseng et al., 2020b).
- Con respecto al Alzehimer se encontró relación entre esta patología y la presencia de amalgamas de mercurio de 1,07 en hombres y de 1,132 en mujeres (Sun et al., 2015).
Finalmente varias artículos científicos han mostrado que hay personas que desarrollan dermatitis alérgica por el mercurio presente en los empastes de amalgamas de mercurio (Thomson y Russell, 1970; Feuerman, 1975; Adachi et al., 2000; Athavale et al., 2003; Ditrichova et al., 2007; Fujii, 2017).
¿Por qué entonces algunos países permiten seguir utilizando empastes de amalgamas de mercurio?
Los resultados de dos estudios clínicos, uno en Nueva Inglaterra y el otro en Portugal, conocidos como Children´s Amalgam Trials (Bellinger et al., 2006; DeRounen et al., 2006) han sido considerados como referencia internacional y han hecho que la Food and Drug Administration (FDA) y la American Dental Association (ADA) hayan apoyado que se sigan usando (FDA, 2009; ADA, 2013; FDA, 2013; revisado en Homme et al., 2014).
El estudio New England Children’s Amalgam Trial analizó a 534 niños durante 5 años mientras que el Portugal Children’s Amalgam Trial analizó a 507 niños durante 7 años. En ambos estudios clínicos no se encontraron alteraciones neurológico-comportamentales entre el grupo con amalgamas y los que no las tenían, aunque en ambos estudios los sujetos del grupo con amalgamas mostraban un incremento estadísticamente significativo en los niveles de mercurio en orina (Bellinger et al., 2006; DeRounen et al., 2006).
Sin embargo, posteriores reanálisis de los estudios previamente citados muestran alteraciones bioquímicas y fisiológicas inducidas por los empastes de amalgamas de mercurio (revisado en Homme et al., 2014):
- En 2011 un reanálisis comparando los efectos entre personas con amalgamas y las que no pero teniendo en cuanta el tamaño de la amalgama así como el tiempo de exposición, muestra una asociación dependiente de dosis estadísticamente significativa entre las amalgamas y presencia en orina de porfirinas asociadas con la carga corporal de mercurio (pentacarboxiporfirina, precoproporfirina, coproporfirina) (Geier et al., 2011).
- Por otro lado, en un reanálisis utilizando el genotipo como variable independiente (niños con una variante genética común llamada CPOX4) en 2012 (por parte de cuatro de los autores del equipo original) encontraron relación estadísticamente significativa entre alteraciones neurológico-comportamentales y exposición al mercurio de las amalgamas, siendo éstos más predominantes en niños que en niñas (Woods et al., 2012).
- En 2013, otro reanálisis encontró una asociación significativa dependiente de dosis entre amalgamas de mercurio y un biomarcador (GST-α) de daño renal (Geier et al., 2013).
- Finalmente, otro reanálisis en 2013 muestra una asociación estadísticamente significativa dependiente de dosis entre alteraciones neurológico-comportamentales y niños con amalgamas de mercurio y con unas variantes comunes para dos proteínas metalotioneína (MT1M y MT2A), siendo más importantes en niños que en niñas (Woods et al., 2013). También es necesario dejar constancia que los autores afirman que la exposición de mercurio no solo vino de los empastes de amalgamas por lo que no pueden concluir que el 100% de sus resultados sean debidos a éstos.
Legislación en Europa
La máxima autoridad en seguridad alimentaria en Europa, la European Food Safety Authority (ESFA), público un informe en el que plantea como probable que la exposición a la inhalación de mercurio elemental a partir de las amalgamas dentales aumente la exposición interna al mercurio inorgánico y por lo tanto, la ingesta semanal tolerable podría ser excedida (ESFA, 2012).
La Comisión Europea presentará al Parlamento Europeo y al Consejo en 2022 una propuesta legislativa para eliminar gradualmente el uso de empastes de amalgamas de mercurio (
https://op.europa.eu/en/publication-detail/-/publication/3a9f2a6c-e070-11ea-ad25-01aa75ed71a1/language-en).
Legislación en EE.UU.
Si bien no están prohibidos, a partir de 2020 la FDA ha establecido una serie de grupos poblacionales en los que los empastes de amalgamas de mercurio implican un riesgo para la salud:
- Mujeres embarazadas y sus fetos en desarrollo.
- Mujeres que quieran quedarse embarazadas.
- Mujeres lactantes y sus recién nacidos y bebés.
- Niños, especialmente los menores de seis años.
- Personas con enfermedades neurológicas preexistentes.
- Personas con insuficiencia renal.
- Personas con hipersensibilidad conocida (alergia) al mercurio u otros componentes de la amalgama dental.
Estos son los links de la FDA para que quien quiera los pueda consultar directamente:
Resulta sorprendente que la FDA no los considere responsables de problemas para la salud pero sí que incluya estos grupos poblacionales.
-
Abraham JE, Svare CW, Frank CW. The effect of dental amalgam restorations on blood mercury levels. J Dent Res. 1984 Jan;63(1):71-3. doi: 10.1177/00220345840630011801.
-
Adachi A, Horikawa T, Takashima T, Ichihashi M. Mercury-induced nummular dermatitis. J Am Acad Dermatol. 2000 Aug;43(2 Pt 2):383-5. doi: 10.1067/mjd.2000.102457.
-
Ask K, Akesson A, Berglund M, Vahter M. Inorganic mercury and methylmercury in placentas of Swedish women. Environ Health Perspect. 2002 May;110(5):523-6. doi: 10.1289/ehp.02110523.
-
Athavale PN, Shum KW, Yeoman CM, Gawkrodger DJ. Oral lichenoid lesions and contact allergy to dental mercury and gold. Contact Dermatitis. 2003 Nov;49(5):264-5. doi: 10.1111/j.0105-1873.2003.0225g.x.
-
Barregard L, Fabricius-Lagging E, Lundh T, Mölne J, Wallin M, Olausson M, Modigh C, Sallsten G. Cadmium, mercury, and lead in kidney cortex of living kidney donors: Impact of different exposure sources. Environ Res. 2010 Jan;110(1):47-54. doi: 10.1016/j.envres.2009.10.010.
-
Bellinger DC, Trachtenberg F, Barregard L, Tavares M, Cernichiari E, Daniel D, McKinlay S. Neuropsychological and renal effects of dental amalgam in children: a randomized clinical trial. JAMA. 2006 Apr 19;295(15):1775-83. doi: 10.1001/jama.295.15.1775.
-
Bjørklund G. Mercury in the dental office. Risk evaluation of the occupational environment in dental care. Tidsskr Nor Laegeforen. 1991 Mar 20;111(8):948-51. Norwegian.
-
Björkman L, Lundekvam BF, Laegreid T, Bertelsen BI, Morild I, Lilleng P, Lind B, Palm B, Vahter M. Mercury in human brain, blood, muscle and toenails in relation to exposure: an autopsy study. Environ Health. 2007 Oct 11;6:30. doi: 10.1186/1476-069X-6-30.
-
Brune D. Metal release from dental biomaterials. Biomaterials. 1986 May;7(3):163-75. doi: 10.1016/0142-9612(86)90097-9.
-
DeRouen TA, Martin MD, Leroux BG, Townes BD, Woods JS, Leitão J, Castro-Caldas A, Luis H, Bernardo M, Rosenbaum G, Martins IP. Neurobehavioral effects of dental amalgam in children: a randomized clinical trial. JAMA. 2006 Apr 19;295(15):1784-92. doi: 10.1001/jama.295.15.1784.
-
Ditrichova D, Kapralova S, Tichy M, Ticha V, Dobesova J, Justova E, Eber M, Pirek P. Oral lichenoid lesions and allergy to dental materials. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2007 Dec;151(2):333-9. doi: 10.5507/bp.2007.057.
-
Drasch G, Aigner S, Roider G, Staiger F, Lipowsky G. Mercury in human colostrum and early breast milk. Its dependence on dental amalgam and other factors. J Trace Elem Med Biol. 1998 Mar;12(1):23-7. doi: 10.1016/s0946-672x(98)80017-5.
-
Dunn JE, Trachtenberg FL, Barregard L, Bellinger D, McKinlay S. Scalp hair and urine mercury content of children in the Northeast United States: the New England Children's Amalgam Trial. Environ Res. 2008 May;107(1):79-88. doi: 10.1016/j.envres.2007.08.015. Epub 2007 Oct 24.
-
Eneström S, Hultman P. Does amalgam affect the immune system? A controversial issue. Int Arch Allergy Immunol. 1995 Mar;106(3):180-203. doi: 10.1159/000236843.
-
Feuerman EJ. Recurrent contact dermatitis caused by mercury in amalgam dental fillings. Int J Dermatol. 1975 Nov;14(9):657-60. doi: 10.1111/j.1365-4362.1975.tb00158.x.
-
Fujii Y. Severe dermatitis might be caused by a cross-reaction between nickel and palladium and dental amalgam resolved following removal of dental restorations. Clin Case Rep. 2017 Apr 12;5(6):795-800. doi: 10.1002/ccr3.938.
-
Geier DA, Carmody T, Kern JK, King PG, Geier MR. A dose-dependent relationship between mercury exposure from dental amalgams and urinary mercury levels: a further assessment of the Casa Pia Children's Dental Amalgam Trial. Hum Exp Toxicol. 2012 Jan;31(1):11-7. doi: 10.1177/0960327111417264. Epub 2011 Jul 29.
-
Geier DA, Carmody T, Kern JK, King PG, Geier MR. A dose-dependent relationship between mercury exposure from dental amalgams and urinary mercury levels: a further assessment of the Casa Pia Children's Dental Amalgam Trial. Hum Exp Toxicol. 2012 Jan;31(1):11-7. doi: 10.1177/0960327111417264. Epub 2011 Jul 29.
-
Geier DA, Carmody T, Kern JK, King PG, Geier MR. A significant dose-dependent relationship between mercury exposure from dental amalgams and kidney integrity biomarkers: a further assessment of the Casa Pia children's dental amalgam trial. Hum Exp Toxicol. 2013 Apr;32(4):434-40. doi: 10.1177/0960327112455671. Epub 2012 Aug 14.
-
Geier DA, Carmody T, Kern JK, King PG, Geier MR. A significant relationship between mercury exposure from dental amalgams and urinary porphyrins: a further assessment of the Casa Pia children's dental amalgam trial. Biometals. 2011 Apr;24(2):215-24. doi: 10.1007/s10534-010-9387-0. Epub 2010 Nov 5.
-
Gilmour CC, Podar M, Bullock AL, Graham AM, Brown SD, Somenahally AC, Johs A, Hurt RA Jr, Bailey KL, Elias DA. Mercury methylation by novel microorganisms from new environments. Environ Sci Technol. 2013 Oct 15;47(20):11810-20. doi: 10.1021/es403075t. Epub 2013 Sep 26.
-
Guzzi G, Grandi M, Cattaneo C, Calza S, Minoia C, Ronchi A, Gatti A, Severi G. Dental amalgam and mercury levels in autopsy tissues: food for thought. Am J Forensic Med Pathol. 2006 Mar;27(1):42-5. doi: 10.1097/01.paf.0000201177.62921.c8.
-
Heintze SD, Rousson V. Clinical effectiveness of direct class II restorations - a meta-analysis. J Adhes Dent. 2012 Aug;14(5):407-31. doi: 10.3290/j.jad.a28390.
-
Holmes AS, Blaxill MF, Haley BE. Reduced levels of mercury in first baby haircuts of autistic children. Int J Toxicol. 2003 Jul-Aug;22(4):277-85. doi: 10.1080/10915810305120.
-
Homme KG, Kern JK, Haley BE, Geier DA, King PG, Sykes LK, Geier MR. New science challenges old notion that mercury dental amalgam is safe. Biometals. 2014 Feb;27(1):19-24. doi: 10.1007/s10534-013-9700-9. Epub 2014 Jan 14.
-
Hsu YC, Chang CW, Lee HL, Chuang CC, Chiu HC, Li WY, Horng JT, Fu E. Association between History of Dental Amalgam Fillings and Risk of Parkinson's Disease: A Population-Based Retrospective Cohort Study in Taiwan. PLoS One. 2016 Dec 1;11(12):e0166552. doi: 10.1371/journal.pone.0166552.
-
Kern JK, Geier DA, Bjørklund G, King PG, Homme KG, Haley BE, Sykes LK, Geier MR. Evidence supporting a link between dental amalgams and chronic illness, fatigue, depression, anxiety, and suicide. Neuro Endocrinol Lett. 2014;35(7):537-52.
-
Lorscheider FL, Vimy MJ, Summers AO, Zwiers H. The dental amalgam mercury controversy--inorganic mercury and the CNS; genetic linkage of mercury and antibiotic resistances in intestinal bacteria. Toxicology. 1995a Mar 31;97(1-3):19-22. doi: 10.1016/0300-483x(94)02964-v.
-
Lorscheider FL, Vimy MJ, Summers AO. Mercury exposure from "silver" tooth fillings: emerging evidence questions a traditional dental paradigm. FASEB J. 1995b Apr;9(7):504-8.
-
Luglie PF, Campus G, Chessa G, Spano G, Capobianco G, Fadda GM, Dessole S. Effect of amalgam fillings on the mercury concentration in human amniotic fluid. Arch Gynecol Obstet. 2005 Feb;271(2):138-42. doi: 10.1007/s00404-003-0578-6. Epub 2003 Dec 20.
-
Mikhailichenko N, Yagami K, Chiou JY, Huang JY, Wang YH, Wei JC, Lai TJ. Exposure to Dental Filling Materials and the Risk of Dementia: A Population-Based Nested Case Control Study in Taiwan. Int J Environ Res Public Health. 2019 Sep 6;16(18):3283. doi: 10.3390/ijerph16183283.
-
Mutter J, Naumann J, Guethlin C. Comments on the article "the toxicology of mercury and its chemical compounds" by Clarkson and Magos (2006). Crit Rev Toxicol. 2007;37(6):537-49; discussion 551-2. doi: 10.1080/10408440701385770.
-
Mutter J, Naumann J, Sadaghiani C, Walach H, Drasch G. Amalgam studies: disregarding basic principles of mercury toxicity. Int J Hyg Environ Health. 2004 Sep;207(4):391-7. doi: 10.1078/1438-4639-00305.
-
Olstad ML, Holland RI, Wandel N, Pettersen AH. Correlation between amalgam restorations and mercury concentrations in urine. J Dent Res. 1987 Jun;66(6):1179-82. doi: 10.1177/00220345870660061701.
-
Oskarsson A, Schültz A, Skerfving S, Hallén IP, Ohlin B, Lagerkvist BJ. Total and inorganic mercury in breast milk in relation to fish consumption and amalgam in lactating women. Arch Environ Health. 1996 May-Jun;51(3):234-41. doi: 10.1080/00039896.1996.9936021.
-
Palkovicova L, Ursinyova M, Masanova V, Yu Z, Hertz-Picciotto I. Maternal amalgam dental fillings as the source of mercury exposure in developing fetus and newborn. J Expo Sci Environ Epidemiol. 2008 May;18(3):326-31. doi: 10.1038/sj.jes.7500606. Epub 2007 Sep 12.
-
Shin SR, Han AL. Improved chronic fatigue symptoms after removal of mercury in patient with increased mercury concentration in hair toxic mineral assay: a case. Korean J Fam Med. 2012 Sep;33(5):320-5. doi: 10.4082/kjfm.2012.33.5.320. Epub 2012 Sep 27.
-
Stejskal V, Ockert K, Bjørklund G. Metal-induced inflammation triggers fibromyalgia in metal-allergic patients. Neuro Endocrinol Lett. 2013;34(6):559-65.
-
Stejskal VD, Danersund A, Lindvall A, Hudecek R, Nordman V, Yaqob A, Mayer W, Bieger W, Lindh U. Metal-specific lymphocytes: biomarkers of sensitivity in man. Neuro Endocrinol Lett. 1999;20(5):289-298.
-
Summers AO, Wireman J, Vimy MJ, Lorscheider FL, Marshall B, Levy SB, Bennett S, Billard L. Mercury released from dental "silver" fillings provokes an increase in mercury- and antibiotic-resistant bacteria in oral and intestinal floras of primates. Antimicrob Agents Chemother. 1993 Apr;37(4):825-34. doi: 10.1128/AAC.37.4.825.
-
Sun YH, Nfor ON, Huang JY, Liaw YP. Association between dental amalgam fillings and Alzheimer's disease: a population-based cross-sectional study in Taiwan. Alzheimers Res Ther. 2015 Nov 12;7(1):65. doi: 10.1186/s13195-015-0150-1.
-
Takahashi Y, Tsuruta S, Arimoto M, Tanaka H, Yoshida M. Placental transfer of mercury in pregnant rats which received dental
amalgam restorations. Toxicology. 2003 Mar 14;185(1-2):23-33. doi: 10.1016/s0300-483x(02)00588-7.
-
Takahashi Y, Tsuruta S, Hasegawa J, Kameyama Y, Yoshida M. Release of mercury from dental amalgam fillings in pregnant rats and distribution of mercury in maternal and fetal tissues. Toxicology. 2001 Jun 21;163(2-3):115-26. doi: 10.1016/s0300-483x(01)00390-0.
-
Thomson J, Russell JA. Dermatitis due to mercury following amalgam dental restorations. Br J Dermatol. 1970 Mar;82(3):292-7. doi: 10.1111/j.1365-2133.1970.tb12440.x.
-
Tseng CF, Chen KH, Yu HC, Chang YC. Association between Dental Amalgam Filling and Essential Tremor: A Nationwide Population-Based Case Control Study in Taiwan. Int J Environ Res Public Health. 2020b Jan 27;17(3):780. doi: 10.3390/ijerph17030780.
-
Tseng CF, Chen KH, Yu HC, Huang FM, Chang YC. Dental Amalgam Fillings and Multiple Sclerosis: A Nationwide Population-Based Case-Control Study in Taiwan. Int J Environ Res Public Health. 2020a Apr 12;17(8):2637. doi: 10.3390/ijerph17082637.
-
Vahter M, Akesson A, Lind B, Björs U, Schütz A, Berglund M. Longitudinal study of methylmercury and inorganic mercury in blood and urine of pregnant and lactating women, as well as in umbilical cord blood. Environ Res. 2000 Oct;84(2):186-94. doi: 10.1006/enrs.2000.4098.
-
Vimy MJ, Lorscheider FL. Serial measurements of intra-oral air mercury: estimation of daily dose from dental amalgam. J Dent Res. 1985 Aug;64(8):1072-5. doi: 10.1177/00220345850640081001.
-
Woods JS, Heyer NJ, Echeverria D, Russo JE, Martin MD, Bernardo MF, Luis HS, Vaz L, Farin FM. Modification of neurobehavioral effects of mercury by a genetic polymorphism of coproporphyrinogen oxidase in children. Neurotoxicol Teratol. 2012 Sep-Oct;34(5):513-21. doi: 10.1016/j.ntt.2012.06.004. Epub 2012 Jul 2.
-
Woods JS, Heyer NJ, Russo JE, Martin MD, Pillai PB, Farin FM. Modification of neurobehavioral effects of mercury by genetic polymorphisms of metallothionein in children. Neurotoxicol Teratol. 2013 Sep-Oct;39:36-44. doi: 10.1016/j.ntt.2013.06.004. Epub 2013 Jul 1.
-
Woods JS, Martin MD, Leroux BG, DeRouen TA, Leitão JG, Bernardo MF, Luis HS, Simmonds PL, Kushleika JV, Huang Y. The contribution of dental amalgam to urinary mercury excretion in children. Environ Health Perspect. 2007 Oct;115(10):1527-31. doi: 10.1289/ehp.10249.
-
Yaqob A, Danersund A, Stejskal VD, Lindvall A, Hudecek R, Lindh U. Metal-specific lymphocyte reactivity is downregulated after dental metal replacement. Neuro Endocrinol Lett. 2006 Feb-Apr;27(1-2):189-97.
-
ADA (American Dental Association) (2013) Statement on dental amalgam. http://www.ada.org/1741.aspx. Accessed 26 Dec 2013.
-
Agency for Toxic Substances and Disease Registry (1999). Toxicological Profile for Mercury. Public Health Service, US Department of Health and Human Services. http: //www.atsdr.cdc.gov/toxprofiles/tp46.pdf. Updated March, 1999. Accessed July, 2014.
-
Berlin M, Zalups RK, Fowler BA (2007). Mercury. In: Nordberg G, Fowler RA, Nordberg M, Friberg LT, editors. Handbook on the toxicology of metals. 3. Burlington: Academic Press.
-
Bjørklund G (1989). The history of dental amalgam (in Norwegian). Journal of the Norwegian Medical Association 109: 3582–3585.
-
Clarkson TW (1989). Mercury. Journal of the American College of Toxicology 8: 1291–1296.
-
Clarkson TW, Friberg L, Nordberg GF, Sager P (1988). Biological Monitoring of Metals. New York, NY: Plenum Press.
-
EFSA Panel on Contaminants in the Food Chain (CONTAM); Scientific Opinion on the risk for public health related to the presence of mercury and methylmercury in food. EFSA Journal 2012;10(12):2985. [241 pp.] doi:10.2903/j.efsa.2012.2985. Available online: www.efsa.europa.eu/efsajournal.
-
FDA (US Food and Drug Administration) (2009) Dental devices: classification of dental amalgam, reclassification of dental mercury, designation of special controls for dental amalgam, mercury, and amalgam alloy. Fed Regist 74(148):38686–38714.
-
FDA (US Food and Drug Administration) (2013) About dental amalgam fillings. http://www.fda.gov/MedicalDevices/ProductsandMedicalProcedures/ DentalProducts/DentalAmalgam/ucm171094.htm. Accessed 26 Dec 2013.
-
Ferracane JL (2001). Materials in dentistry: principles and applications. Philadelphia, PA: Lippincott Williams & Wilkins.